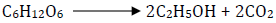Sterilisasi
a. Prinsip dan tujuan Sterilisasi
Apakah anda mengeahui prinsip dan tujuan sterilisasi?
Sterilisasi dalam mikrobiologi adalah suatu proses untuk mematikan semua organisme yang terdapat pada atau dalam suatu benda. Ketika anda pertama kalinya melakukan pemindahan biakan secara aseptik, sesungguhnya anda telah menggunakan salah satu cara sterilisasi , yaitu pembakaran. Namun kebanyakan peralatan dan media yang umum dipakai di dalam pekerjaan mikrobiologis akan menjadi rusak bila dibakar.
Tujuan dari sterilisasi adalah untuk mematikan semua organisme hingga sporanya pada suatu obyek, agar dalam penggunaan benda atau obyek pada kegiatan selanjutnya tidak terjadi kontaminasi atau kegagalan. Suatu tindakan untuk membunuh kuman patogen dan apatogen beserta sporanya pada peralatan perawatan dan kedokteran dengan cara merebus, stoom, panas tinggi atau menggunakan bahan kimia.
b. Metode Sterilisasi
Saat ini informasi yang diperoleh dari bidang mikrobiologi memberikan sumbangan yang sangat besar, khususnya dalam mengawasi penyakit menular. Selain itu, mikroorganisme telah digunakan untuk mempelajari berbagai proses biokimia yang diketahui terjadi pula pada bentuk kehidupan yang lebih tinggi. Banyak fakta tentang metabolisme manusia yang diketahui sekarang mula-mula diketahui terjadi pada mikroorganisme. Demikian pula dengan teknologi yang sekarang sedang popular, misal rekayasa genetik yang tidak lain merupakan perkembangan genetika molekuler yang menjelaskan bagaimana gen mengatur aktivitas sel. Semua ini berasal dari studi tentang mikroorganisme. Jadi bidang mikrobiologi tidak hanya studi tentang penyebab penyakit tetapi merupakan studi tentang semua aktivitas hayati mikroorganisme.
Mikroorganisme banyak dipelajari di laboratorium untuk banyak tujuan. Derajat perinciannya untuk mempelajari itu tergantung kepada maksud pemeriksaan laboratorium tersebut. Tersedianya pula teknik untuk menentukan ukuran, bentuk, dan struktur sel-sel individu serta beberapa prosedur untuk menumbuhkan (membiakkan) mikroorganisme di laboratorium.
Pada bahasan berikut ini dititikberatkan pada metode/prosedur untuk membebaskan suatu bahan atau benda dari semua bentuk kehidupan atau yang biasanya dikenal dengan istilah sterilisasi. Sterilisasi merupakan suatu proses untuk mematikan semua organisme yang terdapat pada suatu benda. Proses sterilisasi dapat dibedakan menjadi 3 macam, yaitu penggunaan panas (pemijaran dan udara panas); penyaringan; dan penggunaan bahan kimia seperti etilena oksida, asam perasetat, formaldehida dan glutaraldehida alkalin (Hadioetomo, 1993). Pada prinsipnya sterilisasi dapat dilakukan dengan 3 cara yaitu secara mekanik, fisik dan kimiawi. Berikut penjelasan akan masing-masing cara:
1) Sterilisai Secara Mekanik (filtrasi)
Sterilisasi secara mekanik (filtrasi) menggunakan suatu saringan yang berpori sangat kecil (0.22 mikron atau 0.45 mikron) sehingga mikroba tertahan pada saringan tersebut. Proses ini ditujukan untuk sterilisasi bahan yang peka panas, misalnya larutan enzim dan antibiotik.
Jika terdapat beberapa bahan yang akibat pemanasan tinggi atau tekanan tinggi akan mengalami perubahan atau penguraian, maka sterlisasi yang digunakan adalah dengan cara mekanik, misalnya dengan saringan. Dalam mikrobiologi, penyaringan secara fisik paling banyak digunakan adalah dalam penggunaan filter khusus misalntya filter berkefeld, filter chamberlan, dan filter seitz. Jenis filter yang dipakai tergantung pada tujuan penyaringan dan benda yang akan disaring.
Penyaringan dapat dilakukan dengan mengalirkan gas atau cairan melalui suatu bahan penyaring yang memilki pori-pori cukup kecil untuk menahan mikroorganisme dengan ukuran tertentu. Saringan akan tercemar sedangkan cairan atau gas yang melaluinya akan steril. Alat saring tertentu juga mempergunakan bahan yang dapat mengabsorbsi mikroorganisme. Saringan yang umum dipakai tidak dapat menahan virus. Oleh karena itu, sehabis penyaringan medium masih harus dipanaskan dalam autoclave. Penyaringan dilakukan untuk mensterilkan substansi yang peka tehadap panas seperti serum, enzim, toksin kuman, ekstrak sel dan lain-lain.
• Menyaring cairan
Hal ini dapat dilakukan dengan berbagai filter seperti saringan seitz, yang menggunakan saringan asbestos sebagai alat penyaringannya; saringan berkefeld yang mempergunakan filter yang terbuat dari tanah diatom; saringan chamberland yang mempergunakan filter yang terbuat dari porselen; dan fritted glass filter yang mempergunakan filter yang terbuat dari serbuk gelas. Saringan asbes lebih mudah dan lebih murah daripada saringan porselen. Saringan asbes dapat dibuang setelah dipakai, sedangkan saringan porselen terlalu mahal bila dibuang, tetapi terlalu sulit untuk dibersihkan.
• Menyaring udara
Untuk menjaga suatu alat yang sudah steril agar tidak tercemar oleh mikroba atau untuk menjaga agar suatu biakan kuman tidak tercemar oleh kuman yang lain, maka alat-alat tersebut harus ditutup denagn kapas, karena kapas mudah ditembus udara tetapi dapat menahan mikroorganisme. Harus dijaga agar kapas tidak menjadi basah, oleh karena kapas yang basah memungkinkan kuman menembus ke dalam. Untuk mencegah pencemaran oleh kuman-kuman udara pada waktu menuang pembenihan, dapat dipergunakan suatu alat yang disebut laminar flow bench dimana udara yang masuk ke dalamnya disaring terlebih dahulu dengan suatu saringan khusus. Saringan ini ada batas waktu pemakaiannya dan harus diganti dengan yang baru apabila sudah tidak berfungsi lagi.
2) Sterilisasi Secara Fisik
Sterilisasi secara fisik dapat dilakukan dengan pemanasan & penyinaran.
• Pemanasan
- Pemijaran (dengan api langsung): membakar alat pada api secara langsung, contoh alat : jarum inokulum, pinset, batang L dan lain-lain.
- Panas kering: sterilisasi dengan oven kira-kira 160-1800C. Sterilisasi panas kering cocok untuk alat yang terbuat dari kaca misalnya erlenmeyer, tabung reaksi dan lain-lain.
- Uap air panas: konsep ini mirip dengan mengukus. Bahan yang mengandung air lebih tepat menggunakan metode ini supaya tidak terjadi dehidrasi.
- Uap air panas bertekanan: menggunakan autoclave.
• Penyinaran dengan UV
Sinar Ultra Violet juga dapat digunakan untuk proses sterilisasi, misalnya untuk membunuh mikroba yang menempel pada
permukaan interior Safety Cabinet dengan disinari lampu UV
3) Sterilisaisi Secara Kimiawi
Biasanya sterilisasi secara kimiawi menggunakan senyawa desinfektan antara lain alkohol. Antiseptik kimia biasanya dipergunakan dan dibiarkan menguap seperti halnya alkohol. Umumnya isopropil alkohol 70-90% adalah yang termurah namun merupakan antiseptik yang sangat efisien dan efektif. Penambahan yodium pada alkohol akan meningkatkan daya disinfeksinya. Dengan menggunakan iodium, isopropil tidak efektif terhadap spora. Solusi terbaik untuk membunuh spora adalah campuran formaldehid dengan alkohol, tetapi solusi ini terlalu toksik untuk dipakai sebagai antiseptik.
Pemilihan antiseptik terutama tergantung pada kebutuhan dari tujuan tertentu serta efek yang dikehendaki. Perlu juga diperhatikan bahwa beberapa senyawa bersifat iritatif dan kepekaan kulit sangat bervariasi. Zat-zat kimia yang dapat dipakai untuk sterilisasi antara lain yaitu halogen (senyawa klorin, iodium), alkohol, fenol, hidrogen feroksida, zat warna ungu kristal, derivat akridin, rosanalin, detergen, logam berat (hg, Ag, As, Zn), aldehida dan lain-lain
c. Berbagai Prosedur Umum Kerja dalam Mikrobiologi yang Membutuhkan Teknik
1) Desinfeksi Meja Kerja/Sterilisasi Meja Kerja
• Singkirkan semua barang yang tidak diperlukan dari meja dan ruang kerja
• b)Semprot meja kerja denga alkohol 70 % beberapa kali hingga merata
• Semprotkan juga alkohol pada telapak tangan
• Letakkan alat dan bahan-bahan yang diperlukan pada meja kerja dan semprotkan kembali alkohol pada semua peralatan.
• Diamkan beberapa saat dan semprotkan kembali alkohol ke seluruh permukaan tangan ketika hendak mulai bekerja.
• Letakkan pembakar spiritus lalu biarkan.
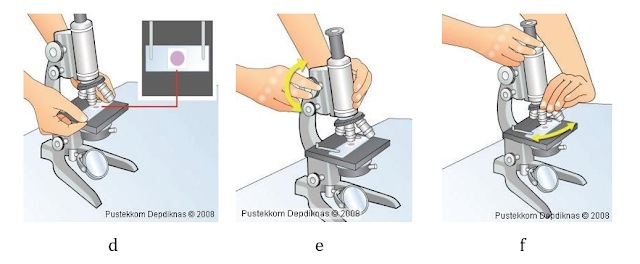
2) Memindahkan biakan secara aseptis
• Siapkan alat dan bahan seperti spirirtus, jarum inokulum (jarum ose), rak tabung dan dua buah tabung tertutup yang berisi biakan bakteri/virus.
• Bakar ujung hingga pangkal jarum inokulum dengan pembakar spirirtus.
• Buka tutup kedua tabung dan bakar mulut kedua buah tabung tersebut dengan pembakar spiritus agar kontaminan mati.
• Ambil satu ulasan pada tabung pertama dengan jarum inokulum kemudian masukkan jarum tadi pada tabung kedua dengan teknik spread zig-zag.
• Bakar kembali mulut tabung agar kontaminasi pada proses transfer mati.
• Tutup kembali tabung tersebut dan bakar ujung jarum inokulum untuk membunuh sisa bakteri yang ada.
3) Memindahkan biakan dari cawan
• Persiapkan alat dan bahan yang akan digunakan.
• Bakar mulut cawan bagian tepi dengan memutarnya di atas api, serta pijarkan jarum inokulum dan dinginkan.
• Buka mulut cawan yang berisi biakan koloni dan ambil koloni tunggalnya dengan menempelkan jarum inokulum loop.
• Tanamkan kembali koloni yang sudah diambil tadi pada media yang baru dengan teknik spread kontinyu.
• Panaskan kembali mulut cawan dan tutup rapat serta panaskan jarum inokulum yang telah digunakan.
4) Memindahkan cairan dengan pipet
• Siapkan alat dan bahan-bahan yang akan digunakan.
• Lepaskan bungkus pipet dan panaskan ujung pipet pada pembakar spiritus (Usahakan daerah ujung pipet berdekatan dengan api).
• Ambil dua buah tabung dan buka tutupnya untuk dipanaskan bagian ujung mulut tabung.
• Pipet cairan pada tabung pertama dengan menekan tombol S pada filler dengan volume tertentu. Kemudian pindahkan ke tabung lainnya dan keluarkan cairan tersebut dengan menekan E pada filler.
• Bakar kedua mulut tabung tadi dan tutup kembali dengan rapat.
5) Menuangkan Media
• Siapkan alat dan bahan yang akan digunakan.
• Panaskan mulut erlenmeyer yang berisi media pertumbuhan mikroorganisme.
• Tuangkan media dalam erlemneyer ke cawan petri yang berisi biakan murni.
• Ratakan dengan menggoyangkan cawan.
Autoclave

Autoclave merupakan alat serupa tangki minyak yang dapat diisi dengan uap. Media yang akan disterilkan ditempatkan dalam autoclave selama 15–20 menit, hal ini tergantung kepada sedikit banyaknya barang yang akan disterilkan. Media yang akan disterilkan itu lebih baik ditempatkan dalam beberapa botol yang kecil daripada dikumpul dalam satu botol yang besar. Setelah pintu autoclave ditutup rapat, barulah kran pada pipa uap dibuka dan temperatur akan terus- menerus naik. Biasanya autoclave sudah diatur sedemikian rupa, sehingga pada suhu 121 0C akan ada tekanan sebesar 15 lbs (pounds) per inch persegi yang berarti 1 atmosfer per 1 cm2 . Perhitungan waktu 15 atau 20 menit itu dimulai sejak termometer pada autoclave menunjuk 121 0C. Setelah cukup waktu maka kran uap ditutup dan dengan demikian akan terlihat bahwa suhu mulai turun sedikit demi sedikit, demikian pula manometer.
Autoclave tidak boleh dibuka secara tiba-tiba. Jika dilakukan demikian, maka isi botol yang ada di dalam autoclave akan meluap. Sangat disarankan menunggu sampai manometer menunjukkan 0 (nol), barulah autoclave dibuka. Pendinginan dilakukan sedikit demi sediki . Jika medium mengandung vitamin, gelatin atau jenis gula, maka setelah dilakukan sterilisasi dalam autoclave, medium tersebut harus segera didinginkan setelah dikeluarkan dari autoclave. Hal ini dilakukan untuk menghindarkan terurainya zat- zat tersebut. Medium yang sudah steril dapat disimpan dalam lemari es.
Cara Penggunaan autoclave model lain:
1) Sebelum melakukan sterilisasi cek terlebih dahulu banyaknya air dalam autoclave. Jika air kurang dari batas yang ditentukan, maka dapat ditambah air sampai batas tersebut. Gunakan air hasil destilasi untuk menghindari terbentuknya kerak dan karat.
2) Masukkan peralatan dan bahan. Jika mensterilisasi botol bertutup ulir, maka tutup harus dikendorkan.
3) Tutup autoclave dengan rapat lalu kencangkan baut pengaman agar tidak ada uap yang keluar dari bibir autoclave. Klep pengaman jangan dikencangkan terlebih dahulu.
4) Nyalakan autoclave, diatur timer dengan waktu minimal 15 menit pada suhu 121oC.
5) Tunggu sampai air mendidih sehingga uapnya memenuhi kompartemen autoclave dan terdesak keluar dari klep pengaman. Kemudian klep pengaman ditutup (dikencangkan) dan tunggu sampai selesai. Penghitungan waktu 15 menit dimulai sejak tekanan mencapai 2 atm.
6) Jika alarm tanda selesai berbunyi, maka tunggu tekanan dalam kompartemen turun hingga sama dengan tekanan udara di lingkungan (jarum pada preisure gauge menunjuk ke angka nol). Kemudian klepklep pengaman dibuka dan keluarkan isi autoclave dengan hati-hati.
Suhu dan tekanan tinggi yang diberikan kepada alat dan media yang disterilisasi memberikan kekuatan yang lebih besar untuk membunuh sel dibanding dengan udara panas. Biasanya untuk mensterilkan media digunakan suhu 1210C dan tekanan 15 lb/in2 (SI = 103,4 Kpa) selama 15 menit. alasan digunakan suhu 1210C atau 249,8 0F adalah karena air mendidih pada suhu tersebut jika digunakan tekanan 15 psi. Untuk tekanan 0 psi pada ketinggian di permukaan laut (sea level) air mendidih pada suhu 1000C, sedangkan untuk autoclave yang diletakkan di ketinggian sama, menggunakan tekanan 15 psi maka air akan mendididh pada suhu 1210C. Kejadian ini hanya berlaku untuk sea level, jika dilaboratorium terletak pada ketinggian tertentu, maka pengaturan tekanan perlu disetting ulang. Misalnya autoclave diletakkan pada ketinggian 2700 kaki dpl, maka tekanan dinaikkan menjadi 20 psi supaya tercapai suhu 1210C untuk mendidihkan air. Semua bentuk kehidupan akan mati jika dididihkan pada suhu 1210C dan tekanan 15 psi selama 15 menit.
Pada saat sumber panas dinyalakan, air dalam autoclave lama kelamaan akan mendidih dan uap air yang terbentuk mendesak udara yang mengisi autoclave. Setelah semua udara dalam autoclave diganti dengan uap air, katup uap/udara ditutup sehingga tekanan udara dalam autoclave naik.
Pada saat tercapai tekanan dan suhu yang sesuai, maka proses sterilisasi dimulai dan timer mulai menghitung waktu mundur. Setelah proses sterilisasi selesai, sumber panas dimatikan dan tekanan dibiarkan turun perlahan hingga mencapai 0 psi. Autoclave tidak boleh dibuka sebelum tekanan mencapai 0 psi.
Untuk mendeteksi bahwa autoclave bekerja dengan sempurna dapat digunakan mikroba pengguji yang bersifat termofilik dan memiliki endospora yaitu Bacillus stearothermophillus, lazimnya mikroba ini tersedia secara komersial dalam bentuk spore strip. Kertas spore strip ini dimasukkan dalam autoclave dan disterilkan. Setelah proses sterilisasi lalu ditumbuhkan pada media. Jika media tetap bening maka menunjukkan autoclave telah bekerja dengan baik.
Beberapa media atau bahan yang tidak disterilkan dengan autoclave adalah
a) Bahan tidak tahan panas seperti serum, vitamin, antibiotik dan enzim
b) Pelarut organik, seperti fenol
c) Buffer dengan kandungan detergen, seperti SDS
Untuk mencegah terjadinya presipitasi, pencoklatan (media menjadi coklat) dan hancurnya substrat dapat dilakukan pencegahan sebagai berikut :
a) Glukosa disterilkan terpisah dengan asam amino (peptone) atau senyawa fosfat
b) Senyawa fosfat disterilkan terpisah dengan asam amino (peptone) atau senyawa garam mineral lain.
c) Senyawa garam mineral disterilkan terpisah dengan agar
d) Media yang memiliki pH > 7,5 jangan disterilkan dengan autoclave
e) Jangan mensterilisasi larutan agar dengan pH < 6,0
Erlenmeyer hanya boleh diisi media maksimum ¾ dari total volumenya, sisa ruang dibiarkan kosong. Jika mensterilkan media 1 liter yang ditampung pada erlenmeyer 2 liter maka sterilisasi diatur dengan waktu 30 menit.
d. Sterilisasi Alat- Alat Gelas
Gelas, botol, pipa, pipet, tabung reaksi yang sudah bersih tidak disterilkan di dalam autoclave, karena barang-barang tersebut akan tetap basah sehabis disterilisasi. Alat-alat dari gelas dimasukkan dalam oven kering selama 2-3 jam pada temperatur 1600C -1800C, hal ini tergantung banyak sedikitnya muatan yang dimasukkan ke dalam oven. Kapas masih dapat bertahan dalam oven kering selama waktu dan pada temperatur tersebut. Alat - alat yang belum bersih dan belum kering tidak boleh dimasukkan dalam oven kering. Pensterilan alat- alat dapat pula dilakukan dengan gas etilen oksida. Hal ini harus dikerjakan dengan hati-hati, karena ada bahaya letusan .



1) Sterilisasi dengan penyaringan (filtrasi)
Sterilisasi dengan penyaringan dilakukan untuk mensterilisasi cairan yang mudah rusak jika terkena panas atau mudah menguap (volatile). Cairan yang disterilisasi dilewatkan ke suatu saringan (ditekan dengan gaya sentrifugasi atau pompa vakum) yang berpori dengan diameter yang cukup kecil untuk menyaring bakteri. Virus tidak akan tersaring dengan metode ini.
2) Tyndalisasi
Konsep kerja metode ini mirip dengan mengukus. Bahan yang mengandung air dan tidak tahan tekanan atau suhu tinggi lebih tepat disterilkan dengan metode ini. Misalnya susu yang disterilkan dengan suhu tinggi akan mengalami koagulasi dan bahan yang berpati disterilkan pada suhu bertekanan pada kondisi pH asam akan terhidrolisis.
Cara kerja :
• Bahan dimasukkan ke dalam erlenmeyer atau botol dan ditutup rapat dengan sumbat atau aluminium foil.
• Erlenmeyer/botol lalu dimasukkan kedalam alat sterilisasi (alat standar menggunakan Arnold Steam Sterilizen atau dandang).
• Nyalakan sumber panas dan tunggu hingga termometer menunjukkan suhu 1000C kemudian hitung waktu mundur hingga 30 menit (uap panas yang terbentuk akan mematikan mikroba).
• Setelah selesai alat sterilisasi dimatikan dan bahan yang steril dikeluarkan.
• Setelah 24 jam, bahan tersebut disterilkan lagi dengan cara yang sama, sedang waktu ini dimaksudkan untuk memberi kesempatan spora atau sel vegetatif yang belum mati untuk tumbuh sehingga mudah dibunuh.
3) Sterilisasi dengan udara panas (dry heat sterilization)
Sterilisasi dengan metode ini biasanya digunakan untuk peralatan gelas seperti cawan petri, pipet ukur dan labu erlenmyer. Alat gelas yang disterilisasi dengan udara panas tidak akan timbul kondensasi sehingga tidak ada tetes air (embun) dalam alat gelas. Metode yang dilakukan adalah sebagai berikut:
• Bungkus alat-alat gelas dengan kertas payung atau aluminium foil Atur pengatur suhu oven menjadi 1800C dan alat disterilkan selama 2-3 jam.
a) Prinsip kerja Biological Saferty Cabinet (BSC)
Biological Safety Cabinet merupakan kabinet kerja yang disterilkan untuk kerja mikrobiologi. BSC memiliki suatu pengatur aliran udara yang menciptakan aliran udara kotor (dimungkinkan ada kontaminan) untuk disaring dan diresirkulasi melalui filter. BSC juga disebut biosafety hood, dan juga dikenal dengan Laminar flowhood atau Class II vertical flow cabinet yang menyediakan alat filtrasi dan aliran udara yang bersirkulasi didalam ruang kerja. Aliran udara diatur untuk menghambat udara luar masuk dan udara di dalam keluar, untuk mencegah kontaminasi dari luar dan pencemaran bakteri dari ruang BSC. Udara yang keluar disaring melewati penyaring sehingga sel-sel yang berbahaya tidak lepas keluar ke ruangan lain.
Berbagai kelas Biological Safety Cabinet.
BSC yang dimiliki Lab mikrobiologi merupakan BSC kelas II yang memiliki konfigurasi udara. Udara yang berasal dari luar kabinet akan langsung terserap masuk ke saluran bawah yang bergabung dengan udara dari meja kerja yang dimungkinkan mengandung bakteri yang digunakan untuk kerja. Udara dari meja kerja disedot dari depan meja kerja. Kemudian udara kotor ini disaring oleh penyaring HEPA dan disirkulasikan keluar kabinet atau kembali lagi ke meja kerja sebagai udara bersih.
Jenis peralatan yang dapat disterilkan
• Peralatan yang terbuat dari logam, misalnya pinset, gunting, speculum dan lain-lain.
• Peralatan yang terbuat dari kaca, misalnya semprit (spuit), tabung kimia dan lain-lain.
• Peralatan yang terbuat dari karet, misalnya, kateter, sarung tangan, pipa penduga lambung, drain dan lain-lain.
• Peralatan yang terbuat dari ebonit, misalnya kanule rectum, kanule trachea dan lain-lain.
• Peralatan yang terbuat dari email, misalnya bengkok
(nierbekken), baskom dan lain-lain.
• Peralatan yang terbuat dari porselin, misalnya mangkok, cangkir, piring dan lain-lain.
• Peralatan yang terbuat dari plastik, misalnya slang infus dan lain-lain.
• Peralatan yang terbuat dari tenunan, misalnya kain kasa, tampon, doek operasi, baju, sprei, sarung bantal dan lain-lain.
Pelaksanaan:
• Sterilisasi dengan cara rebus: mensterikan peralatan dengan cara merebus di dalam air sampai mendidih (1000C) dan ditunggu antara 15 sampai 20 menit. Misalnya peralatan dari logam, kaca dan karet.
• Sterilisasi dengan cara stoom: mensterikan peralatan dengan uap panas didalam autoclave dengan waktu, suhu dan tekanan tertentu. Misalnya alat tenun, obat-obatan dan lain-lain.
• Sterilisasi dengan cara panas kering: mensterilkan peralatan dengan oven dengan uap panas tinggi. Misalnya peralatan logam yang tajam, peralatan dari kaca dan obat tertentu.
• Sterilisasi dengan cara menggunakan bahan kimia: Mensterilkan peralatan dengan menggunakan bahan kimia seperti alkohol, sublimat, uap formalin, khususnya untuk peralatan yang cepat rusak bila terkena panas, misalnya sarung tangan, kateter dan lain-lain.
Yang harus menjadi perhatian dalam melakukan sterilisasi adalah :
• Sterilisator harus dalam keadaan siap pakai. Peralatan harus bersih dan masih berfungsi.
• Peralatan yang dibungkus harus diberi label dengan jelas mencantumkan : nama, jenis peralatan, tanggal dan jam disterilkan.
• Menyusun peralatan di dalam sterilisator harus sedemikian rupa, sehingga seluruh bagian dapat disterilkan.
• Waktu yang diperlukan untuk mensterilkan setiap jenis peralatan harus tepat (dihitung sejak peralatan disterilkan).
• Dilarang memasukkan atau menambahkan peralatan lain ke dalam sterilisator, sebelum waktu untuk mensterilkan selesai.
• Memindahkan peralatan yang sudah steril ke tempatnya harus dengan korentang steril.
• Untuk mendinginkan peralatan steril dilarang membuka bungkus maupun tutupnya.
• Bila peralatan yang baru disterilkan terbuka, peralatan tersebut harus disterilkan kembali.