Teknik Pengecatan / Pewarnaan Bakteri
1) Teknik Pengecatan Bakteri secara Sederhana
Sel–sel mikroorganisme yang tidak diwarnai umumnya tampak hampir tembus pandang (transparan) bila diamati dengan mikroskop cahaya biasa sehingga sukar dilihat karena sitoplasma selnya mempunyai indeks bias yang hampir sama dengan indeks bias lingkungannya yang bersifat cair. Kontras antar sel dan latar belakangnya dapat dipertajam dengan mewarnai sel–sel tersebut dengan zat- zat warna.
Pewarna yang paling umum digunakan adalah “pewarna sederhana“, disebut demikian karena hanya digunakan satu jenis zat warna untuk mewarnai organisme tersebut. Kebanyakan bakteri mudah bereaksi dengan pewarna- pewarna sederhana karena sitoplasmanya bersifat basofilik (suka akan basa). Zat- zat warna yang digunakan untuk pewarnaan sederhana umumnya bersifat alkalin (komponen kromoforiknya bermuatan positif ).
Pewarnaan sederhana ini memungkinkan dibedakannya bakteri dengan bermacam–macam tipe morfologi ( kokus, basilus, vibrio, spirilum, dan sebagainya) dari bahan – bahan lainya yang ada pada olesan yang diwarnai. Selain itu dapat pula diamati struktur-struktur tertentu seperti endospora. Berbeda dengan spesimen hidup, sel–sel yang diwarnai terfiksasi pada kaca obyek sehingga dapat disimpan sebagai dokumentasi untuk jangka waktu lama.
Berikut akan disampaikan prosedur pewarnaan/pengecetan bakteri secara sederhana
- Bahan yang dibutuhkan :
- Olesan – olesan mikroorganisme
- Laruran zat warna metilen blue
- Larutan zat warna karbol fuksin
- Bak warna
- Air suling dalam botol pijit/ botol cuci
- Kertas serap
- Mikroskop, minyak celup, kertas lensa
- Prosedur/Cara melakukan:
- Gunakan olesan bakteri yang telah difiksasi, dengan menggunakan 2 olesan untuk masing – masing mikroorganisme. Olesan pertama akan diwarnai dengan metelin blue dan yang kedua akan diwarnai dengan karbol fuksin
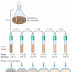
- Dengan berpedoman gambar berikut, lakukan pewarnaan sederhana sebagai berikut :
- Letakkan kaca – kaca obyek berisi olesan yang akan diwarnai di atas bak pewarna dan genangi olesan tersebut dengan zat warna yang dimaksud. Bila digunakan metilen blue biarkan olesan terwarnai selama 1-2 menit, bila digunakan karbol fuksin biarkan olesan terwarnai selama 15- 30 detik.
- Peganglah kaca obyek dengan pinset atau penjepit lain dan miringkan. Bilaslah zat warna tersebut dengan air sampai warna yang terkandung dalam air yang mengalir dari kaca obyek tersebut hanya tinggal sedikit sekali.
- Seraplah air yang tersisa pada permukaan spesimen dengan kertas serap.
 |
| Prosedur Pewarnaan Sederhana |
2) Pengamatan
Amatilah masing- masing preparat di bawah mikroskop dengan obyektif celup minyak tanpa kaca tutup (mulailah dengan obyektif berkekuatan terendah dan berangsur–angsur diganti dengan yang berkekuatan tinggi). Pada setiap olesan amati morfologi spesimen anda (bentuk, susunan, macam- macam stadium, struktur khusus seperti endospora). Gambarkanlah sketsa pengamatan anda pada tiap–tiap olesan dengan skala dan warna yang sesuai, Cantumkan pula nama masing–masing mikroorganisme. Tanyakan kepada guru apabila ada yang belum jelas. Hasil pengamatan buatlah kesimpulan dan presentasikan di depan kelas.
Secara umum proses pewarnaan bakteri bisa dilakukan sebagai berikut
- Bakteri haruslah diambil dari suatu biakan yang masih muda, kira- kira umur 24 jam, merupakan usia yang baik untuk memperlihatkan bentuk morfologinya. Jika ingin melihat bakteri yang sudah membentuk spora, maka perlulah diambil bakteri yang sudah lebih tua, yaitu dari suatu biakan yang berumur 2 sampai 3 kali 24 jam.
- Bakteri diratakan di atas kaca obyek/glass obyek yang bersih, seluas kira-kira 1 cm2 . Hindarilah pengambilan bakteri yang terlalu banyak. Jika tidak diratakan tipis-tipis, maka bakteri akan bertumpuk sehingga pemeriksaan bentuknya satu persatu tidak akan jelas.
- Jika sudah kering, sediaan perlu dilewatkan pada nyala api perlahan -lahan supaya bakteri melekat pada kaca obyek, sehingga tidak akan terhapus apabila sediaan dicuci. Jaga jangan sampai bidang yang mengandung bakteri terkena nyala api.
- Zat warna diteteskan pada bidang yang mengandung bakteri. Juga mungkin seluruh kaca obyek tersebut direndam miring dalam zat warna, hal ini bergantung pada sifat khusus pewarnaan, dan kadang- kadang juga bergantung kepada banyak sedikitnya kaca obyek (preparat ) yang harus dibuat. Zat warna diberi waktu beberapa lama supaya diserap oleh bakteri yang sudah kering, tergantung dari sifat khas zat warna yang digunakan .
- Sediaan dicuci dengan alkohol atau asam encer, untuk menghilangkan zat warna yang berlebihan. Alkohol yang digunakan untuk mencuci dapat berupa alkohol 15% sampai 95%, kadang juga diperlukan alkohol 100%. Cara mencucinya adalah dengan mencelupkan sediaan ke dalam alkohol atau ke dalam asam encer dengan tanpa dikocek. Ada pula zat warna yang dicuci dengan air murni ataupun air kran.
- Tunggu sediaan sampai kering lalu diperiksa dengan mikroskop, bila perlu dengan menggunakan minyak cedar (minyak imersi atau minyak celup). Jika dikehendaki , sediaan dapat ditutup dengan kaca penutup sebelum ditempatkan di atas piringan mikroskop. Sediaan yang diinginkan untuk disimpan lama perlu perlakuan sebagai berikut: Permukaan yang mengandung bakteri ditetesi balsem kanada kemudian ditutup dengan kaca penutup yang bersih. Sebelum kering, sediaan tidak boleh diletakkan miring. Sesudah balsem kanada kering, baru sediaan dapat dimasukkan ke kotak penyimpan sediaan, dalam posisi miring. Selanjutnya preparat disimpan dalam tempat gelap dan sejuk, agar supaya zat warna tidak lekas luntur dan pudar. Lebih jelas terlihat pada gambar berikut:
 |
| Proses Pewarnaan bakteri |
3) Pewarnaan Gram
Prosedur pewarnaan sederhana yang anda lakukan seperti pada penjelasan sebelumnya, memungkinkan untuk melihat bakteri dengan jelas, tetapi tidak dapat membedakan jenis- jenis bakteri yang berbeda dengan morfologi yang sama.
Pada tahun 1884, seorang ahli bakteriologi Denmark secara kebetulan menemukan prosedur pewarnaan Gram. Pewarnaan ini mungkin merupakan salah satu prosedur yang amat penting dan paling banyak digunakan dalam klasifikasi bakteri. Melalui metode ini , bakteri dapat dipisahkan secara umum menjadi dua kelompok besar yaitu:
- Organisme yang dapat menahan kompleks pewarna primer ungu kristal iodium sampai pada akhir prosedur (sel –sel tampak biru gelap atau ungu), disebut Gram positif
- Organisme yang kehilangan kompleks warna ungu kristal pada waktu pembilasan dengan alkohol namun kemudian diwarnai oleh pewarna tandingan safranin (sel- sel tampak merah muda ) disebut Gram negatif.
Karena kemampuanya untuk membedakan satu kelompok bakteri tertentu dari kelompok lainya, pewarnaan Gram disebut juga pewarnaan diferensial. Sekalipun mekanisme yang tepat dari pewarnaan Gram masih belum jelas , diketahui bahwa komposisi dinding sel bakteri Gram-positif berbeda dari bakteri Gram-negatif dan ini diduga berperan dalam terjadinya reaksi Gram yang berbeda–beda . Boleh jadi dinding sel yang lebih tebal pada bakteri Gram positif menyusut oleh perlakuan alkohol karena terjadinya dehidrasi, menyebabkan pori- pori dinding sel menutup sehingga mencegah larutnya kompleks ungu kristal iodium pada langkah pemucatan. Pada pihak lain, sel–sel Gram negatif mempunyai kandungan lipid yang lebih tinggi pada dinding selnya dan lipid pada umumnya larut dalam alkohol dan aseton. Larutnya lipid oleh pemucatan yang digunakan dalam pewarnaan Gram diduga memperbesar pori- pori dinding sel dan inilah yang menyebabkan proses pemucatan pada sel- sel Gram negatif berlangsung lebih cepat. Terdapat perbedaan yang nyata dalam laju pemucatan antara sel-sel Gram positif dan Gram negatif. Terlepas dari tepat atau tidaknya dugaan tersebut, yang jelas dinding sel itulah yang merupakan penghalang terhadap pemucatan pada sel – sel Gram positif. Pendapat ini di dukung oleh kenyataan bahwa berubahnya atau dibuangnya dinding sel bakteri Gram positif menyebabkan organisme tersebut berubah menjadi Gram negatif.
Perbedan reaksi Gram bukanlah suatu fenomena yang mutlak dan kaku, melainkan merupakan perbedaan laju lepasnya kompleks ungu kristal –iodium dari sel pada langkah pemucatan. Organisme Gram positif sekalipun dapat memperlihatkan reaksi Gram negatif bila mengalami pemucatan yang berlebihan.
Faktor- faktor yang dapat menimbulkan keragaman dalam reaksi Gram ialah :
- Pelaksanaan fiksasi panas terhadap olesan
- Kerapatan sel pada olesan
- Konsentrasi dan umur reagen-reagen yang digunakan untuk pewarnaan Gram
- Sifat konsentrasi dan jumlah pemucat yang dipakai
- Sejarah biakan
Olesan bakteri yang dipanaskan secara berlebihan akan menyebabkan pecahnya dinding sel. Dalam keadaan demikian maka sel–sel Gram positif akan melepaskan warna primer dan menerima warna tandingan. Hal ini mendukung teori bahwa reaksi Gram tergantung pada struktur dinding sel.
Olesan yang baik hendaknya jangan terlalu tebal atau terlalu tipis. Pada pewarnaan Gram, olesan yang terlampau tebal tidak akan memucat secepat seperti olesan dengan kerapatan yang normal.
Sebagai pemucat, etanol 95 % bekerja paling lambat, sedangkan aseton paling cepat sehingga pemucat yang paling banyak digunakan adalah campuran etanol 95% dan aseton dengan perbandingan (1: 1), Namun untuk siswa yang masih belajar melakukan pewarnaan Gram sebaiknya menggunakan pemucat yang bekerja lambat yaitu dengan etanol 95 % untuk memperkecil kemungkinan terjadinya pemucatan yang berlebihan.
Sejarah biakan yang dimaksud tersebut adalah meliputi umur biakan serta keasaman atau alkalinitas (pH) medium tempat bakteri yang bersangkutan ditumbuhkan. Biakan organisme Gram positif yang lebih tua (terutama apabila memperlihatkan autolisis) dan yang ditumbuhkan dalam medium asam seringkali tampak gram negatif atau gram variabel (artinya biakan yang sama menampakkan sel-sel baik Gram positif maupun Gram negatif. Hal ini berkaitan dengan permebilitas dinding sel pada biakan tua yang menyebabkan hilangnya sifat Gram positif. Tetapi organisme Gram negatif tidak menjadi Gram positif terlepas dari umur atau medium yang dipergunakan. Secara singkatnya, reaksi Gram hanya dapat dipercaya bagi biakan berumur 24 jam atau kurang, dan janganlah terlampau mempersoalkan teramatinya beberapa sel Gram negatif di dalam suatu preparat yang sebagian besar menampakkan sel- sel Gram positif.
Apakah anda sudah pernah melakukan pewarnaan Gram?
Lakukan pewarnaan dengan mengikuti prosedur sebagai berikut:
- Bahan
- Kaca obyek bersih
- Pensil lilin atau spidol
- Lup inokulasi
- Suspensi campuran sel- sel muda Escherichia coli dan Staphylococcus aureus (berumur 15- 18 jam)
- Biakan murni Serratia marsescens yang telah di isolasi
- Biakan murni Micrococcus luteus
- Biakan Bacillus subtilis dan kaldu nutrien
- Seperangkat pewarna gram: ungu kristal, larutan iodium gram, alkohol 95%, safranin
- Bak warna
- Air suling dalam botol pijit
- Kertas serap
- Mikroskop
- Minyak celup dan kertas lensa
- Prosedur
- Sediakan 4 buah kaca obyek yang bersih
- Dengan mengikuti cara- cara penyiapan olesan yang baik , Siapkan olesan bakteri pada keempat buah kaca obyek tersebut sebagai berikut:
- Siapkanlah 2 olesan pada setiap kaca obyek. Jarak antara kedua olesan tersebut paling sedikit 2 cm
- Salah satu dari kedua olesan itu sama bagi keempat kaca obyek, yaitu olesan disiapkan dari suspensi campuran sel–sel muda E. coli dan S. aureus, olesan ini berfungsi sebagai kontrol
- Olesan kedua pada masing –masing kaca obyek adalah :
- Olesan S. marcescens pada kaca obyek pertama
- Olesan M.luteus pada kaca obyek kedua
- Olesan B.subtilis berumur 18 jam pada obyek ketiga
- Olesan B. subtilis berumur 72 jam pada kaca obyek keempat
- Tandailah setiap olesan pada masing – masing kaca obyek supaya anda tahu apa yang akan anda amati nanti
Setelah selesai difiksasi panas, letakkan kaca- kaca obyek tadi di atas rak kawat pada bak pewarna. Dengan berpedoman gambar berikut ini, lakukanlah pewarnaan Gram sebagai berikut :
- Genangi olesan bakteri dengan pewarna primer yaitu ungu kristal selama 1 menit
- Dengan menggunakan pinset atau penjepit lain, miringkanlah kaca obyek di atas bak pewarna untuk membuang kelebihan ungu kristal, lalu bilaslah olesan dengan air dari botol pijit/botol pembersih
- Tiriskan kaca obyek (dengan cara menegakkan sisi- sisi yang sempit kaca obyek tersebut di atas kertas serap) dan kembalikan ke atas rak kawat pada bak pewarna
- Genangi olesan dengan iodium gram selama 2 menit
- Miringkan kaca obyek untuk membuang kelebihan iodium lalu bilaslah olesan dengan air dari botol pijit
- Cucilah olesan dengan pemucat warna yaitu etanol 95 %, tetes demi tetes selama 30 detik atau sampai zat warna ungu kristal tidak terlihat lagi mengalir dari kaca obyek
- Cucilah segera dengan air dari botol pijit, lalu tiriskan dan kembalikan ke atas rak kawat pada bak pewarna
- Genangi olesan dengan pewarna tandingan yaitu safranin selama 30 detik,
- Miringkan kaca obyek ,untuk membuang kelebihan safranin, lalu bilaslah olesan dengan air dari botol pijit
- Tiriskan kaca obyek dan seraplah kelebihan air pada olesan dengan menekankan kertas serap hati- hati keatasnya
 |
| prosedur pewarnaan gram |
Pengamatan
Amati masing-masing preparat di bawah mikroskop dengan obyektif celup minyak tanpa kaca tutup (mulailah dengan obyektif berkekuatan terendah dan berangsur–angsur diganti dengan yang berkekuatan tinggi ) . Pada setiap preparat mula- mula amatilah olesan kontrol, karena olesan ini merupakan ukuran bagi ketepatan teknik pewarnaan anda. Bila teknik anda baik , maka S.aureus akan berwarna biru gelap atau ungu (Gram positif ) dan E. coli akan berwarna merah muda (Gram negatif) . Baru kemudian anda mengamati olesan yang lain. Gambar dan beri keterangan dan warna yang sesuai gambar anda amati











0 Comment to "Teknik Pengecatan / Pewarnaan Bakteri"
Post a Comment