Kapang
Kapang adalah sekelompok mikroba yang tergolong dalam fungi dengan ciri khas memiliki filament (miselium).Kapang termasuk mikroba yang penting dalam mikrobiologi pangan karena selain berperan penting dalam industri makanan, kapang juga menjadi penyebab kerusakan pangan.Jumlah dan jenis kapang dalam suatu makanan, dapat menentukan apakah makanan tersebut layak dikonsumsi.
Pengertian dan Ciri-Ciri Kapang
Banyak istilah yang dipergunakan untuk menyebut jamur atau fungi, seperti cendawan, kapang, lapuk atau khamir. Jamur yang berbentuk filament disebut kapang, sedangkan khamir biasanya untuk sebutan yang uniseluler dan yang lebih mencolok penampilannya disebut jamur, misalnya jamur merang, jamur kelentos, dan jamur hijau. Kapang adalah mikroba yang tergolong dalam fungi memiliki lebih dari satu sel berupa benang benang halus yang disebut hifa, kumpulan hifa disebut miselium, dan berkembang biak dengan spora. Kapang termasuk mikroba yang penting dalam mikrobiologi pangan karena selain berperan penting dalam industri makanan, kapang juga banyak menjadi penyebab kerusakan pangan.
Berikut merupakan ciri-ciri kapang :
- Merupakan organisme yang tidak berklorofil, oleh karena itu bersifat heterotrof. Hidup sebagai parasit, saprofit, dan ada pula yang bersimbiosis.
- Bersifat eukarion (mempunyai inti yang sejati), yaitu materi inti dibungkus oleh membran inti.
- Ada yang bersel tunggal dan ada pula yang bersel banyak, yang bersel banyak berbentuk benang atau filamen. Berdasarkan sifat tersebut ukuran jamur sangat bervariasi dari yang sangat kecil (mikroskopis) sampai yang berukuran cukup besar (makroskopis).
- Berkembang biak secara vegetatif dan generatif.
- Menyenangi lingkungan yang agak asam, kurang cahaya, terutama di tempat-tempat lembab yang mengandung zat organik.
- Fungi yang bersel banyak tubuhnya tersusun dari benang-benang yang disebut hifa, yang berdiameter 5-10 mikrometer. Hifa dapat bercabangcabang membentuk anyaman yang disebut miselium. Pada beberapa fungi, dinding sel atau dinding hifa mengandung selulosa, tetapi pada umumnya terutama terdiri atas nitrogen organik, yaitu kitin.
Jenis jenis Kapang
Kapang memiliki berbagai peran dalam kehidupan. Ada kapang yang bersifat menguntungkan ataupun merugikan.
Beberapa jenis kapang yang penting dalam mikrobiologi pangan antara lain:
1) Rhizopus
Rhizopus sering disebut kapang roti karena sering tumbuh dan menyebabkan kerusakan pada roti. Selain itu, kapang ini juga sering dijumpai pada sayuran dan buah-buahan. Spesies Rhizopus yang sering tumbuh pada roti adalah Rhizopus stolonifer dan Rhizopus nigricans. Selain merusak makanan, Rhizopus juga berperan dalam pembuatan beberapa makanan fermentasi, misalnya Rhizopus Oligosporus dan Rhizopus Oryzae yang digunakan dalam fermentasi tempe dan oncom.
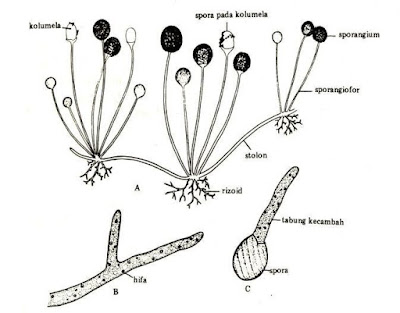
Morfologi rhizopus dapat dilihat pada gambar dibawah ini.
 |
| Rhizopus |
Dari gambar diatas, dapat disimpulkan bahwa ciri-ciri Rhizopus antara lain:
a. Hifa nonseptat
b. Mempunyai stolon dan rhizoid yang berwarna gelap jika sudah tua
c. Sporangiofora tumbuh pada titik dimana terbentuk juga rhizoid
d. Sporangia biasanya besar dan berwarna hitam
e. Kolumela agak bulat dan apofisis berbentuk seperti cangkir
f. Tidak mempunyai sporangiola
g. Membentuk hifa vegetatif yang melakukan penetrasi pada substrat dan hifa fertil yang memproduksi sporangia pada ujung sporangiofora
h. Pertumbuhannya membentuk misellium seperti kapas
a. Hifa nonseptat
b. Mempunyai stolon dan rhizoid yang berwarna gelap jika sudah tua
c. Sporangiofora tumbuh pada titik dimana terbentuk juga rhizoid
d. Sporangia biasanya besar dan berwarna hitam
e. Kolumela agak bulat dan apofisis berbentuk seperti cangkir
f. Tidak mempunyai sporangiola
g. Membentuk hifa vegetatif yang melakukan penetrasi pada substrat dan hifa fertil yang memproduksi sporangia pada ujung sporangiofora
h. Pertumbuhannya membentuk misellium seperti kapas
2) Aspergillus
Aspergillus merupakan kapang yang tumbuh pada media dengan konsentrasi gula dan garam tinggi, oleh karena itu dapat tumbuh pada makanan dengan kadar air rendah. Salah satu jenis dari Aspergillus yang berperan dalam fermentasi beberapa makanan tradisional adalah Aspergillus oryzae. Jenis kapang ini digunakan dalam fermentasi tahap pertama pembuatan kecap dan tauco.
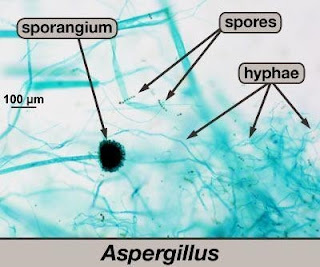 |
| Aspergillus |
Dari gambar diatas, dapat kita lihat bahwa ciri morfologi Aspergillus antara lain :
a. Hifa septat dan miselium bercabang, biasanya tidak berwarna, yang terdapat dibawah permukaan merupakan hifa vegetatif sedangkan yang muncul diatas permukaan adalah hifa fertil.
b. Koloni kelompok
c. Konidiofora septat dan nonseptat
d. Konidiofora membesar menjadi vesikel pada ujungnya
e. Sterigmata biasanya sederhana berwarna atau tidak berwarna
f. Konidia membentuk rantai yang berwarna hijau, coklat, atau hitam
g. Beberapa spesies tumbuh baik pada suhu 37"C atau lebih
Mutu Produk dan Jumlah kapang
Kapang dapat bersifat menguntungkan dan merugikan.Beberapa jenis kapang bersifat merugikan karena kapangmembentuk mikotoksin yang dikenal sebagai penyebab keracunan akut (Depkes RI, 1998).Salah satu contoh mikotoksin yang diproduksi oleh kapang yang sering mencemari makanan adalah Aflatoksin.Toksin ini dihasilkan oleh kapang Aspergillus flavus dan mencemari bahan makanan seperti kacang-kacangan, jagung, dan serealia.
Berbeda dengan toksin yang diproduksi oleh bakteri, mikotoksin pada umumnya tidak menyebabkan penyakit yang bersifat akut. Tetapi timbulnya penyakit biasanya disebabkan oleh konsumsi mikotoksin dalam jumlah kecil secara berulang-ulang dalam jangka waktu yang lama
(Supardi, 1999)
(Supardi, 1999)
Keadaan makanan yang telah ditumbuhi kapang yang tidak diinginkan pada permukaannya menandakan bahwa makanan tersebut tidak aman untuk dikonsumsi.Membersihkan kapang pada makanan melalui pencucian tidak dapat mengurangi kemungkinan bahaya yang timbul karena toksin yang diproduksi oleh kapang selama pertumbuhannya dapat terserap ke bagian dalam makanan.Umumnya mikotoksin bersifat tahan panas, sehingga pengolahan atau pemanasan tidak menjamin hilangnya atau berkurangnya keaktifan mikotoksin yang ada.