Struktur Atom
A. Perkembangan Pemahaman Mengenai Struktur AtomSetiap materi di alam semesta ini tersusun atas partikel-partikel yang sangat kecil yang oleh para ahli dikenal dengan nama atom. Sejak dahulu kala pertama manusia berpikir tentang zat penyusun setiap materi, kemudian dirumuskannya teori atom dan sampai sekarang di zaman yang serba canggih ini, keberadaan atom sudah diterima semua orang, tetapi bagaimana bentuk sebenarnya atom tersebut serta penyusunnya belum diketahui secara pasti. Para ahli hanya mereka-reka berdasarkan pengamatan di laboratorium terhadap gejala yang ditimbulkan jika suatu materi diberi perlakukan tertentu. Dari pengamatan gejala-gejala tersebut para ahli kemudian membuat teori tentang atom dan memperkirakan bentuk atom tersebut yang dikenal dengan sebutan model atom. Model-model atom yang diusulkan oleh para ahli mengalami per-kembangan sampai sekarang dan akan terus berkembang seiring dengan semakin canggihnya instrumen laboratorium yang ditopang oleh kemajuan iptek yang luar biasa.
1. Model Atom Dalton
 Tahukah Anda bahwa di dunia ilmu kimia ini patut dikenang satu nama sebagai pencetus teori atom modenyang asli. Dia adalah seorang guru dan ahli kimia berkebangsaan Inggris bernama John Dalton (1776 –1844). Sumbangan Dalton merupakan keunikan dari teorinya yang meliputi dua hal:
Tahukah Anda bahwa di dunia ilmu kimia ini patut dikenang satu nama sebagai pencetus teori atom modenyang asli. Dia adalah seorang guru dan ahli kimia berkebangsaan Inggris bernama John Dalton (1776 –1844). Sumbangan Dalton merupakan keunikan dari teorinya yang meliputi dua hal:a. Dia adalah orang pertama yang melibatkan kejadian kimiawi seperti halnya kejadian fisis dalam merumuskan gagasannya tentang atom.
b. Dia mendasarkan asumsinya pada data kuantitatif, tidak menggunakan pengamatan kualitatif atau untung-untungan.
Teori atom Dalton dikemukakan berdasarkan dua hukum, yaitu hukum kekekalan massa dan hukum perbandingan tetap. Teori atom Dalton dikembangkan selama periode 1803-1808 dan didasarkan atas tiga asumsi pokok, yaitu:
a. Setiap unsur kimia tersusun oleh partikel-partikel kecil yang tidak dapat dihancurkan dan dipisahkan yang disebut atom. Selama mengalami perubahan kimia, atom tidak bisa diciptakan dan dimusnahkan.
b. Semua atom dari suatu unsur mempunyai massa dan sifat yang sama, tetapi atom-atom dari suatu unsur berbeda dengan atom-atom dari unsur yang lain, baik massa maupun sifat-sifatnya yang berlainan.
c. Dalam senyawa kimiawi, atom-atom dari unsur yang berlainan melakukan ikatan dengan perbandingan angka sederhana.
2 . Model Atom Thompson
Pada tahun 1897 J. J. Thompson menemukan elektron. Berdasarkan penemuannya tersebut, kemudian Thompson mengajukan teori atom baru yang dikenal dengan sebutan model atom Thompson. Model atom Thompson dianalogkan seperti sebuah roti kismis, di mana atom terdiri atas materi bermuatan positif dan di dalamnya tersebar elektron bagaikan kismis dalam roti kismis. Karena muatan positif dan negatif bercampur jadi satu dengan jumlah yang sama, maka secara keseluruhan atom menurut Thompson bersifat netral (Martin S. Silberberg, 2000).
3. Model Atom Rutherford
Antoine Henri Becquerel (1852-1908), seorang ilmuwan dari Perancis pada tahun 1896 menemukan bahwa uranium dan senyawa-senyawanya secara spontan memancarkan partikel-partikel. Partikel yang dipancarkan itu ada yang bermuatan listrik dan memiliki sifat yang sama dengan sinar katode atau elektron.
Unsur-unsur yang memancarkan sinar itu disebut unsur radioaktif, dan sinar yang dipancarkan juga dinamai sinar radioaktif. Ada tiga macam sinar radioaktif, yaitu:
a. sinar alfa (α), yang bermuatan positif
b. sinar beta (β), yang bermuatan negatif
c. sinar gama(γ), yang tidak bermuatan
Sinar alfa dan beta merupakan radiasi partikel. Setiap partikel sinar alfa bermuatan +2 dengan massa 4 sma, sedangkan partikel sinar beta sama dengan elektron, bermuatan –1 dan massa 1/1.840 sma (dianggap sama dengan nol). Adapun sinar gama adalah radiasi elektromagnet, tidak bermassa, dan tidak bermuatan.
Pada tahun 1908, Hans Geiger dan Ernest Marsden yang bekerja di laboratorium Rutherford melakukan eksperimen dengan menembakkan sinar alfa (sinar bermuatan positif) pada pelat emas yang sangat tipis. Sebagian besar sinar alfa itu berjalan lurus tanpa gangguan, tetapi sebagian kecil dibelokkan dengan sudut yang cukup besar, bahkan ada juga yang dipantul- kan kembali ke arah sumber sinar.
Dari hasil percobaan kedua asistennya itu, Ernest Rutherford menafsirkan sebagai berikut.
a. Sebagian besar partikel sinar alfa dapat menembus pelat karena melalui daerah hampa.
b. Partikel alfa yang mendekati inti atom dibelokkan karena mengalami gaya tolak inti.
c. Partikel alfa yang menuju inti atom dipantul- kan karena inti bermuatan positif dan sangat massif (Martin S. Silberberg, 2000).

Percobaan Rutherford menembakkan sinar alfa pada lempengan emas tipis.
Beberapa tahun kemudian, yaitu tahun 1911, Ernest Rutherford meng- ungkapkan teori atom modern yang dikenal sebagai model atom Rutherford.
a. Atom tersusun dari:
1) Inti atom yang bermuatan positif.
2) Elektron-elektron yang bermuatan negatif dan mengelilingi inti.
b. Semua proton terkumpul dalam inti atom, dan menyebabkan inti atom bermuatan positif.
c. Sebagian besar volume atom merupakan ruang kosong. Hampir semua massa atom terpusat pada inti atom yang sangat kecil. Jari-jari atom sekitar 10–10 m, sedangkan jari-jari inti atom sekitar 10–15 m.
d. Jumlah proton dalam inti sama dengan jumlah elektron yang mengelilingi inti, sedangkan atom bersifat netral.
4. Model Atom Niels Bohr
Dilihat dari kandungan energi elektron, ternyata model atom Rutherford mempunyai kelemahan. Ketika elektron-elektron mengelilingi inti atom, mereka mengalami percepatan terus-menerus, sehingga elektron harus membebaskan energi. Lama kelamaan energi yang dimiliki oleh elektron makin berkurang dan elektron akan tertarik makin dekat ke arah inti, sehingga akhirnya jatuh ke dalam inti. Tetapi pada kenyataannya, seluruh elektron dalam atom tidak pernah jatuh ke inti. Jadi, model atom Rutherford harus disempurnakan.
Dua tahun berikutnya, yaitu pada tahun 1913, seorang ilmuwan dari Denmark yang bernama Niels Henrik David Bohr (1885-1962) menyempurnakan model atom Rutherford. Model atom yang diajukan Bohr dikenal sebagai model atom Ruther- ford-Bohr, yang dapat diterangkan sebagai berikut.
a. Elektron-elektron dalam atom hanya dapat melintasi lintasan-lintasan tertentu yang disebut kulit-kulit atau tingkat- tingkat energi, yaitu lintasan di mana elektron berada pada keadaan stationer, artinya tidak memancarkan energi.
b. Kedudukan elektron dalam kulit-kulit, tingkat-tingkat energi dapat disamakan dengan kedudukan seseorang yang berada pada anak-anak tangga. Seseorang hanya dapat berada pada anak tangga pertama, kedua, ketiga, dan seterusnya, tetapi ia tidak mungkin berada di antara anak tangga-anak tangga tersebut.
Model atom Bohr tersebut dapat dianalogkan seperti sebuah tata surya mini. Pada tata surya, planet-planet beredar mengelilingi matahari. Pada atom, elektron- elektron beredar mengelilingi atom, hanya bedanya pada sistem tata surya, setiap lintasan (orbit) hanya ditempati 1 planet, sedangkan pada atom setiap lintasan (kulit) dapat ditempati lebih dari 1 elektron. Dalam model atom Bohr ini dikenal istilah konfigurasi elektron, yaitu susu- nan elektron pada masing-masing kulit. Data yang digunakan untuk menuliskankonfigurasi elektron adalah nomor atom suatu unsur, di mana nomor atom unsur menyatakan jumlah elektron dalam atom unsur tersebut. Sedangkan elektron pada kulit terluar dikenal dengan sebutan elektron valensi. Susunan elektron valensi sangat menentukan sifat- sifat kimia suatu atom dan berperan penting dalam membentuk ikatan dengan atom lain.
Untuk menentukan konfigurasi elektron suatu unsur, ada beberapa patokan yang harus selalu diingat, yaitu:
a. Dimulai dari lintasan yang terdekat dengan inti, masing-masing lintasan disebut kulit ke-1 (kulit K), kulit ke-2 (kulit L), kulit ke-3 (kulit M), kulit ke-4 (kulit N), dan seterusnya.
b. Jumlah elektron maksimum (paling banyak) yang dapat menempati masing-masing kulit adalah:
2 n2
dengan n = nomor kulit
Kulit K dapat menampung maksimal 2 elektron.
Kulit L dapat menampung maksimal 8 elektron.
Kulit M dapat menampung maksimal 18 elektron, dan seterusnya.
c. Kulit yang paling luar hanya boleh mengandung maksimal 8 elektron.
B . Partikel Dasar
1 . Sifat-sifat Partikel Dasar
Walaupun pada awalnya atom diartikan sebagai partikel terkecil yang tidak dapat dibagi lagi, tetapi dalam perkembangannya ternyata ditemukan bahwa atom tersusun atas tiga jenis partikel sub-atom (partikel dasar), yaitu proton, elektron, dan neutron.
Massa partikel dasar dinyatakan dalam satuan massa atom (sma), di mana 1 sma = 1,66 × 10–24 gram. Sedangkan muatan partikel dasar dinyatakan sebagai muatan relatif terhadap muatan elektron (e), di mana muatan 1 elektron = e = –1,60 × 10–19 coloumb.
Muatan 1 proton sama dengan muatan 1 elektron, tetapi tandanya berbeda. Massa 1 proton sama dengan massa 1 neutron, masing-masing 1 sma. Massa elektron lebih kecil daripada massa proton atau neutron.
2. Susunan Atom
Henry Gwyn-Jeffreys Moseley (1887 – 1915) pada tahun 1913 mene- mukan bahwa jumlah muatan positif dalam inti atom merupakan sifat khas masing-masing unsur. Atom-atom dari unsur yang sama memiliki jumlah muatan positif yang sama. Moseley kemudian mengusulkan agar istilah nomor atom diberi lambang Z, untuk menyebutkan jumlah muatan positif dalam inti atom.
Nomor atom unsur menunjukkan jumlah proton dalam inti. Setelah dilakukan percobaan, diketahui bahwa atom tidak bermuatan listrik yang berarti dalam atom jumlah muatan positif sama dengan jumlah muatan negatif, sehingga nomor atom juga menunjukkan jumlah elektron dalam unsur.
Nomor atom (Z) = jumlah proton
= jumlah elektron
Misalnya, unsur oksigen memiliki nomor atom 8 (Z = 8), berarti dalam atom oksigen terdapat 8 proton dan 8 elektron. Selain nomor atom, ada juga yang disebut dengan nomor massa yang biasanya diberi lambang A. Nomor massa ini digunakan untuk menentukan jumlah nukleon dalam atom suatu unsur. Nukleon sendiri adalah partikel penyusun inti atom yang terdiri dari proton dan neutron.
A(nomor massa) = jumlah proton (p) + jumlah neutron (n)
Dalam penulisan atom, nomor massa (A) ditulis di sebelah kiri atas, sedangkan nomor atom (Z) ditulis di sebelah kiri bawah dari lambang unsur.
Keterangan: X = lambang unsur
A = nomor massa
Z = nomor atom
Untuk ion (atom bermuatan positif atau negatif) maka notasi ion, jumlah proton, neutron, dan elektron adalah:
C a t a t a n
A Untuk atom netral, jumlah proton sama dengan jumlah elektron.
A Untuk ion positif, jumlah proton (muatan positif) lebih banyak daripada elektron (muatan negatif).
A Untuk ion negatif, jumlah elektron (muatan negatif) lebih banyak daripada proton (muatan positif).
3 . Penemuan Partikel Dasar
a. Penemuan Elektron
Setelah John Dalton (1766-1844) pada tahun 1803 mengemukakan teori atom yang pertama kali, maka tidak lama setelah itu dua orang ilmuwan yaitu Sir Humphry Davy (1778-1829) dan muridnya Michael Faraday (1791-1867), menemukan metode elektrolisis, yaitu cara menguraikan senyawa menjadi unsur-unsurnya dengan bantuan arus listrik. Dengan metode baru itulah akhirnya mereka menemukan bahwa atom mengandung muatan listrik.
Sejak pertengahan abad ke-19, para ilmuwan banyak meneliti daya hantar listrik dari gas-gas pada tekanan rendah. Tabung lampu gas pertama kali dirancang oleh Heinrich Geissler (1829-1879) dari Jerman pada tahun 1854. Rekannya, Julius Plucker (1801-1868), membuat eksperimen sebagai berikut. Dua pelat logam ditempatkan pada masing-masing tabung Geissler yang divakumkan, lalu tabung gelas itu diisi dengan gas pada tekanan rendah. Salah satu pelat logam (disebut anode) membawa muatan positif, dan pelat yang satu lagi (disebut katode) membawa muatan negatif. Ketika muatan listrik bertegangan tinggi dialirkan melalui gas dalam tabung, muncullah nyala berupa sinar dari katode ke anode. Sinar yang dihasilkan ini disebut sinar katode.
Plucker ternyata kurang teliti dalam pengamatannya dan meng- anggap sinar tersebut hanyalah cahaya listrik biasa. Pada tahun 1875, William Crookes (1832-1919) dari Inggris, mengulangi eksperimen Plucker tersebut dengan lebih teliti dan mengungkapkan bahwa sinar katode merupakan kumpulan partikel-partikel yang saat itu belum dikenal.
Hasil-hasil eksperimen Crookes dapat dirangkum sebagai berikut.
1) Partikel sinar katode bermuatan negatif sebab tertarik oleh pelat yang bermuatan positif.
2) Partikel sinar katode mempunyai massa sebab mampu memutar baling-baling dalam tabung.
3) Partikel sinar katode dimiliki oleh semua materi sebab semua bahan yang digunakan (padat,cair, dan gas) menghasilkan sinar katode yang sama.
Partikel sinar katode itu dinamai“elektron” oleh George Johnstone Stoney (1817 – 1895) pada tahun 1891.Pada masa itu para ilmuwan masih diliputi kebingungan dan ketidaktahuan serta ketidak percayaan bahwa setiap materi memiliki ekektron karena mereka masih percaya bahwa atom adalah partikel terkecil penyusun suatu materi. Kalau atom merupakan partikel terkecil, maka di manakah keberadaan elektron dalam materi tersebut?
Pada tahun 1897, Joseph John Thompson (1856 – 1940) dari Inggris melalui serangkaian eksperimennya berhasil mendeteksi atau menemukan elektron yang dimaksud Stoney.
Thompson membuktikan bahwa elektron merupakan partikel penyusun atom, bahkan Thompson mampu menghitung perbandingan muatan terhadap massa elektron yaitu 1,759 × 108 coulomb/gram.
Kemudian pada tahun 1908, Robert Andrew Millikan (1868-1953) dari Universitas Chicago menemukan harga muatan elektron, yaitu 1,602 × 10–19 coulomb. Dengan demikian massa sebuah elektron dapat dihitung.
b. Penemuan Proton
Keberadaan partikel bermuatan positif yang dikandung oleh atom diisyaratkan oleh Eugen Goldstein (1850-1930) pada tahun 1886. Dengan ditemukannya elektron, para ilmuwan semakin yakin bahwa dalam atom pasti ada partikel bermuatan positif untuk mengimbangi muatan negatif dari elektron. Selain itu, jika seandainya partikel penyusun atom hanya elektron-elektron, maka jumlah massa elektron terlalu kecil dibandingkan terhadap massa sebutir atom.
Keberadaan partikel pe- nyusun atom yang bermuatan positif itu semakin terbukti ketika Ernest Rutherford (1871- 1937), orang Selandia Baru yang pindah ke Inggris, pada tahun 1906 berhasil menghitung bahwa massa partikel bermuatan positif itu kira-kira 1.837 kali massa elektron. Kini kita menamai partikel itu proton, nama yang baru dipakai mulai tahun 1919.
Massa 1 elektron
=
9,11 × 10–28 gram
Massa 1 proton
=
1.837 × 9,11 × 10–28 gram
=
1,673 × 10–24 gram
c. Penemuan Neutron
Setelah para ilmuwan mempercayai adanya elektron dan proton dalam atom, maka timbul masalah baru, yaitu jika hampir semua massa atom terhimpun pada inti (sebab massa elektron sangat kecil dan dapat diabaikan), ternyata jumlah proton dalam inti belum mencukupi untuk sesuai dengan massa atom. Jadi, dalam inti pasti ada partikel lain yang menemani proton-proton. Pada tahun 1932, James Chadwick (1891–1974) menemukan neutron-neutron, partikel inti yang tidak bermuatan. Massa sebutir neutron adalah 1,675 × 10–24 gram, hampir sama atau boleh dianggap sama dengan massa sebutir proton.
Jadi sekarang diketahui dan dipercayai oleh para ilmuwan bahwa inti atom tersusun atas dua partikel, yaitu proton (partikel yang bermuatan positif) dan neutron (partikel yang tidak bermuatan). Proton dan neutron mempunyai nama umum, nukleon-nukleon, artinya partikel-partikel inti.
C. Isotop, Isobar, dan Isoton
1 . Isotop
Salah satu teori Dalton menyatakan bahwa atom-atom dari unsur yang sama memiliki massa yang sama. Pendapat Dalton ini tidak sepenuhnya benar. Kini diketahui bahwa atom-atom dari unsur yang sama dapat memiliki massa yang berbeda. Fenomena semacam ini disebut isotop.
Isotop adalah unsur-unsur sejenis yang memiliki nomor atom sama, tetapi memiliki massa atom berbeda atau unsur-unsur sejenis yang memiliki jumlah proton sama, tetapi jumlah neutron berbeda. Sebagai contoh, atom oksigen memiliki tiga isotop, yaitu:
2 . Isobar
Isobar adalah atom dari unsur yang berbeda (mempunyai nomor atom berbeda), tetapi mempunyai nomor massa yang sama. Sebagai contoh:
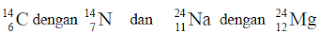
3. Isoton
Isoton adalah atom dari unsur yang berbeda (mempunyai nomor atom berbeda), tetapi mempunyai jumlah neutron sama. Sebagai contoh:






















The King Casino - CommunityKhabar
ReplyDeleteThe King Casino sol.edu.kg is the only casino 바카라 near https://vannienailor4166blog.blogspot.com/ the casino. wooricasinos.info All casino games are communitykhabar legal and the game variety is huge! The games are also available at any of the