Ikatan Kimia
Gaya yang mengikat atom-atom dalam molekul atau gabungan ion dalam setiap senyawa disebut ikatan kimia. Konsep ini pertama kali dikemukakan pada tahun 1916 oleh Gilbert Newton Lewis (1875-1946) dari Amerika dan Albrecht Kossel (1853-1927) dari Jerman (Martin S. Silberberg, 2000). Konsep tersebut adalah:1. Kenyataan bahwa gas-gas mulia (He, Ne, Ar, Kr, Xe, dan Rn) sukar membentuk senyawa merupakan bukti bahwa gas-gas mulia memiliki susunan elektron yang stabil.
2. Setiap atom mempunyai kecenderungan untuk memiliki susunan elektron yang stabil seperti gas mulia. Caranya dengan melepaskan elektron atau menangkap elektron.
3. Untuk memperoleh susunan elektron yang stabil hanya dapat dicapai dengan cara berikatan dengan atom lain, yaitu dengan cara melepaskan elektron, menangkap elektron, maupun pemakaian elektron secara bersama-sama.
1. Konfigurasi Elektron Gas Mulia
Dibandingkan dengan unsur-unsur lain, unsur gas mulia merupakan unsur yang paling stabil. Kestabilan ini disebabkan karena susunan elektronnya berjumlah 8 elektron di kulit terluar, kecuali helium (mempunyai konfigurasi elektron penuh). Hal ini dikenal dengan konfigurasi oktet, kecuali helium dengan konfigurasi duplet.
Unsur-unsur lain dapat mencapai konfigurasi oktet dengan membentuk ikatan agar dapat menyamakan konfigurasi elektronnya dengan konfigurasi elektron gas mulia terdekat. Kecenderungan ini disebut aturan oktet. Konfigurasi oktet (kon- figurasi stabil gas mulia) dapat dicapai dengan melepas, menangkap, atau memasangkan elektron.
Dalam mempelajari materi ikatan kimia ini, kita juga perlu memahami terlebih dahulu tentang lambang Lewis. Lambang Lewis adalah lambang atom disertai elektron valensinya. Elektron dalam lambang Lewis dapat dinyatakan dalam titik atau silang kecil (James E. Brady, 1990).
2. Ikatan Ion
Ikatan ion adalah ikatan yang terjadi akibat perpindahan elektron dari satu atom ke atom lain (James E. Brady, 1990). Ikatan ion terbentuk antara atom yang melepaskan elektron (logam) dengan atom yang menangkap elektron (bukan logam). Atom logam, setelah melepaskan elektron berubah menjadi ion positif. Sedangkan atom bukan logam, setelah menerima elektron berubah menjadi ion negatif. Antara ion-ion yang berlawanan muatan ini terjadi tarik-menarik (gaya elektrostastis) yang disebut ikatan ion (ikatan elektrovalen).
Ikatan ion merupakan ikatan yang relatif kuat. Pada suhu kamar, semua senyawa ion berupa zat padat kristal dengan struktur tertentu. Dengan mengunakan lambang Lewis, pembentukan NaCl digambarkan sebagai berikut.
NaCl mempunyai struktur yang berbentuk kubus, di mana tiap ion Na+ dikelilingi oleh 6 ion Cl– dan tiap ion Cl– dikelilingi oleh 6 ion Na+.
Senyawa ion dapat diketahui dari beberapa sifatnya, antara lain:
1. Merupakan zat padat dengan titik leleh dan titik didih yang relatif tinggi. Sebagai contoh, NaCl meleleh pada 801 °C.
2. Rapuh, sehingga hancur jika dipukul.
3. Lelehannya menghantarkan listrik.
4. Larutannya dalam air dapat menghantarkan listrik.
Contoh lain pembentukan ikatan ion sebagai berikut.
a. Pembentukan MgCl2
Mg (Z = 12) dan Cl (Z = 17) mempunyai konfigurasi elektron sebagai berikut.
- Mg : 2, 8, 2
- Cl : 2, 8, 7
Mg dapat mencapai konfigurasi gas mulia dengan melepas 2 elektron, sedangkan Cl dengan menangkap 1 elektron. Atom Mg berubah menjadi ion Mg2+, sedangkan atom Cl menjadi ion Cl–.
- Mg (2, 8, 2) ⎯⎯→ Mg2+ (2, 8) + 2 e–
(konfigurasi elektron ion Mg2+ sama dengan neon)
- Cl (2, 8, 7) + e– ⎯⎯→ Cl– (2, 8, 8)
(konfigurasi elektron ion Cl– sama dengan argon)
Ion Mg2+ dan ion Cl– kemudian bergabung membentuk senyawa dengan rumus MgCl .
Dengan menggunakan lambang Lewis, pembentukan MgCl kan sebagai berikut.
b. Ikatan antara atom 12Mg dan 8O dalam MgO Konfigurasi elektron Mg dan O adalah:
Mg : 2, 8, 2 (melepas 2 elektron)
O : 2, 6 (menangkap 2 elektron)
Atom O akan memasangkan 2 elektron, sedangkan atom Mg juga akan memasangkan 2 elektron.
c . Ikatan ion pada 19K dan 8O dalam K2O
Konfigurasi elektron:
K : 2, 8, 8, 1 (melepas 1 elektron) membentuk K+
O : 2, 6 (menerima 2 elektron) membentuk O2–
d. Ikatan ion pada Fe (elektron valensi 3) dengan Cl (elektron valensi 7) membentuk FeCl3
Fe mempunyai elektron valensi 3 akan membentuk Fe3+
Cl mempunyai elektron valensi 7 akan membentuk Cl–
3. Ikatan Kovalen
Ikatan kovalen adalah ikatan yang terjadi akibat pemakaian pasangan elektron secara bersama-sama oleh dua atom (James E. Brady, 1990). Ikatan kovalen terbentuk di antara dua atom yang sama-sama ingin menangkap elektron (sesama atom bukan logam).
Cara atom-atom saling mengikat dalam suatu molekul dinyatakan oleh rumus bangun atau rumus struktur. Rumus struktur diperoleh dari rumus Lewis dengan mengganti setiap pasangan elektron ikatan dengan sepotong garis. Misalnya, rumus bangun H2 adalah H – H.
Contoh:
a. Ikatan antara atom H dan atom Cl dalam HCl
Konfigurasi elektron H dan Cl adalah:
H : 1 (memerlukan 1 elektron)
Cl : 2, 8, 7 (memerlukan 1 elektron)
Masing-masing atom H dan Cl memerlukan 1 elektron, jadi 1 atom H akan berpasangan dengan 1 atom Cl. Lambang Lewis ikatan H dengan Cl dalam HCl
b . Ikatan antara atom H dan atom O dalam H O
Konfigurasi elektron H dan O adalah:
H : 1 (memerlukan 1 elektron)
O : 2, 6 (memerlukan 2 elektron)
Atom O harus memasangkan 2 elektron, sedangkan atom H hanya memasangkan 1 elektron. Oleh karena itu, 1 atom O berikatan dengan 2 atom H. Lambang Lewis ikatan antara H dengan O dalam H2O
Dua atom dapat membentuk ikatan dengan sepasang, dua pasang, atau tiga pasang elektron bergantung pada jenis unsur yang berikatan. Ikatan kovalen yang hanya melibatkan sepasang elektron disebut ikatan tunggal (dilambangkan dengan satu garis), sedangkan ikatan kovalen yang melibatkan lebih dari sepasang elektron disebut ikatan rangkap. Ikatan yang melibatkan dua pasang elektron disebut ikatan rangkap dua (dilambangkan dengan dua garis), sedangkan ikatan yang melibatkan tiga pasang elektron disebut ikatan rangkap tiga (dilambangkan dengan tiga garis).
c. Ikatan rangkap dua dalam molekul oksigen (O ) Oksigen (Z = 8) mempunyai 6 elektron valensi, sehingga untuk mencapai konfigurasi oktet harus memasangkan 2 elektron. Pembentukan ikatannya dapat digambarkan sebagai berikut.
Lambang Lewis ikatan O
d. Ikatan rangkap tiga dalam molekul N2
Nitrogen mempunyai 5 elektron valensi, jadi harus memasangkan 3 elektron untuk mencapai konfigurasi oktet. Pembentukan ikatannya dapat digambarkan sebagai berikut.
Lambang Lewis ikatan N
Pasangan elektron yang dipakai bersama-sama disebut pasangan elektron ikatan (PEI), sedangkan yang tidak dipakai bersama-sama dalam ikatan disebut pasangan elektron bebas (PEB). Misalnya:
• Molekul H O mengandung 2 PEI dan 2 PEB
• Molekul NH mengandung 3 PEI dan 1 PEB
• Molekul CH4 mengandung 4 PEI dan tidak ada PEB
A. Ikatan Kovalen Koordinasi
Ikatan kovalen koordinasi adalah ikatan kovalen di mana pasangan elektron yang dipakai bersama hanya disumbangkan oleh satu atom, sedangkan atom yang satu lagi tidak menyumbangkan elektron. Ikatan kovalen koordinasi hanya dapat terjadi jika salah satu atom mempunyai pasangan elektron bebas (PEB).
Contoh:
Atom N pada molekul amonia, NH , mempunyai satu PEB. Oleh karena itu molekul NH
dapat mengikat ion H+ melalui ikatan kovalen koordinasi, sehingga menghasilkan ion amonium, NH +.
Dalam ion NH + terkandung empat ikatan, yaitu tiga ikatan kovalen dan satu ikatan kovalen koordinasi.
B. Polarisasi Ikatan Kovalen
Kedudukan pasangan elektron ikatan tidak selalu simetris terhadap kedua atom yang berikatan. Hal ini disebabkan karena setiap unsur mempunyai daya tarik elektron (keelektronegatifan) yang berbeda-beda. Salah satu akibat dari keelektronegatifan adalah terjadinya polarisasi pada ikatan kovalen.
Perhatikan kedua contoh berikut ini.
Pada contoh (a), kedudukan pasangan elektron ikatan sudah pasti simetris terhadap kedua atom H. Dalam molekul H tersebut muatan negatif (elektron) tersebar homogen. Hal ini dikenal dengan ikatan kovalen nonpolar. Pada contoh (b), pasangan elektron ikatan tertarik lebih dekat ke atom Cl karena Cl mempunyai daya tarik elektron lebih besar daripada H. Hal ini menyebabkan adanya polarisasi pada HCl, di mana atom Cl lebih negatif daripada atom H. Ikatan seperti ini dikenal dengan ikatan kovalen polar.
Kepolaran dinyatakan dengan momen dipol (μ), yaitu hasil kali antara muatan (Q) dengan jarak (r).
μ = Q × r
Satuan momen dipol adalah debye (D), di mana 1 D = 3,33 × 10–30 C m. Momen dipol dari beberapa senyawa diberikan dalam tabel berikut.
4. Pengecualian dan Kegagalan Aturan Oktet
Walaupun aturan oktet banyak membantu dalam meramalkan rumus kimia senyawa biner sederhana, akan tetapi aturan itu ternyata banyak dilanggar dan gagal dalam meramalkan rumus kimia senyawa dari unsur-unsur transisi dan postransisi.
A. Pengecualian Aturan Oktet
Pengecualian aturan oktet dapat dibagi dalam tiga kelompok sebagai berikut.
1. Senyawa yang tidak mencapai aturan oktet.
Senyawa yang atom pusatnya mempunyai elektron valensi kurang dari 4 termasuk dalam kelompok ini. Hal ini menyebabkan setelah semua elektron valensinya dipasangkan tetap belum mencapai oktet. Contohnya adalah BeCl ,
BCl , dan AlBr
2. Senyawa dengan jumlah elektron valensi ganjil.
Contohnya adalah NO , yang mempunyai elektron valensi (5 + 6 + 6) = 17. Kemungkinan rumus Lewis untuk NO sebagai berikut.
3. Senyawa yang melampaui aturan oktet.
Ini terjadi pada unsur-unsur periode 3 atau lebih yang dapat menampung lebih dari 8 elektron pada kulit terluarnya (ingat, kulit M dapat menampung hingga 18 elektron). Beberapa contoh adalah PCl5, SF6, ClF3 , IF7 , dan SbCl5 .
Perhatikan rumus Lewis dari PCl5, SF6, dan ClF3 berikut ini.
B. Kegagalan Aturan Oktet
Aturan oktet gagal meramalkan rumus kimia senyawa dari unsur transisi maupun postransisi. Unsur postransisi adalah unsur logam setelah unsur transisi, misalnya Ga, Sn, dan Bi. Sn mempunyai 4 elektron valensi, tetapi senyawanya lebih banyak dengan tingkat oksidasi +2. Begitu juga Bi yang mempunyai 5 elektron valensi, tetapi senyawanya lebih banyak dengan tingkat oksidasi +1 dan +3. Pada umumnya, unsur transisi maupun unsur postransisi tidak memenuhi aturan oktet.
5. Ikatan Logam
Ikatan elektron-elektron valensi dalam atom logam bukanlah ikatan ion, juga bukan ikatan kovalen sederhana. Suatu logam terdiri dari suatu kisi ketat dari ion- ion positif dan di sekitarnya terdapat lautan (atmosfer) elektron-elektron valensi. Elektron valensi ini terbatas pada permukaan-permukaan energi tertentu, namun mempunyai cukup kebebasan, sehingga elektron-elektron ini tidak terus-menerus digunakan bersama oleh dua ion yang sama. Bila diberikan energi, elektron-elektron ini mudah dioperkan dari atom ke atom. Sistem ikatan ini unik bagi logam dan dikenal sebagai ikatan logam.




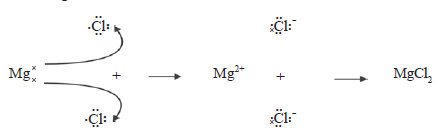










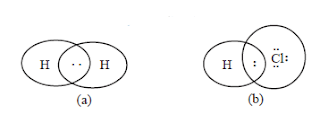











0 Comment to "Ikatan Kimia"
Post a Comment